Você sabia sobre a reação do Santo Graal na química?
April 22, 2024
Quando se trata de gás natural, você não deve estar familiarizado com ele e hoje em dia nenhuma casa pode cozinhar sem ele. O principal componente do gás natural é o metano, que é um dos compostos de hidrocarbonetos mais simples. Acelerar o desenvolvimento e a utilização do metano é a chave para realizar o desenvolvimento verde e sustentável da indústria química e de energia. Além de seu uso direto como combustível, o metano também pode ser usado como um recurso C1, ou seja, uma molécula que contém um átomo de carbono e pode continuar sendo convertido para preparar produtos químicos de alto valor, como metanol, fórmico ácido e assim por diante. O metano pode ser queimado em oxigênio para formar água e dióxido de carbono. Sem combustão, é possível ativar e converter as ligações de hidrocarbonetos das moléculas de metano em condições amenas? A resposta é sim! Esta é a reação do "Santo Graal" no campo da catálise. As reações associadas ao "Santo Graal" geralmente são extremamente desafiadoras, pois podem precisar ser realizadas sob condições muito adversas, ou podem precisar superar as dificuldades inerentes a uma reação química, como a ativação de compostos altamente estáveis, baixo rendimentos e baixa seletividade. Esses desafios dificultam a realização dessas reações, mas se puderem ser alcançadas com sucesso, levarão a avanços significativos em pesquisas científicas e aplicações industriais.

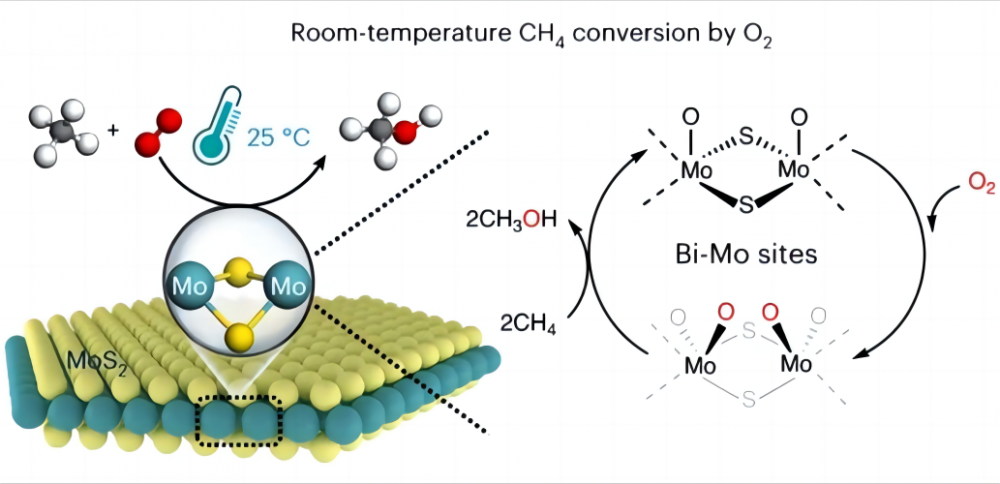
1.Calenges na conversão de metano em baixas temperaturas É muito difícil converter metano diretamente em outros produtos químicos úteis com oxigênio barato a baixas temperaturas ou até temperatura ambiente, por que isso? Vejamos a natureza do metano e do oxigênio. A estrutura química do metano contém quatro ligações idênticas de carbono-hidrogênio (CH) que formam uma configuração ortotetraédrica altamente simétrica, e cada ligação CH3-H do metano tem uma energia de ligação de até 435 kJ/mol. Podemos pensar no vínculo CH do metano como uma primavera particularmente forte. Esta primavera é muito esticada e requer muita força para esticar. Na química, essa "força" é a energia necessária para quebrar a ligação CH. Essa alta energia de ligação torna as ligações CH do metano termodinamicamente estáveis e muito difíceis de quebrar ou reagir sob condições normais. Por outro lado, em reações químicas, os grupos reativos geralmente são gerados sob interação polar (a interação polar é o fenômeno de que uma molécula possui uma extremidade carregada positivamente e a outra carregada negativamente), enquanto a estrutura simétrica e a natureza não polar da molécula de metano previam Ao gerar essa polaridade (de acordo com a configuração molecular, uma molécula com um plano de simetria não possui polaridade) e não pode fornecer grupos reativos. Portanto, a ativação e conversão do metano é muito desafiadora e geralmente requer condições adversas, como altas temperaturas (600-1100 ° C) ou alguns "extremófilos", como ácidos super-fortes e radicais livres para ajudar na ativação do metano. Portanto, a principal dificuldade em realizar a ativação de baixa temperatura de metano e oxigênio está em como ativar a ligação CH do metano, ou seja, como esticar a "mola" na ligação CH. 2.O milagre do catalisador Os cientistas tiveram uma boa solução para esse problema e optaram por usar um catalisador para ajudar a ativar o metano a baixas temperaturas (um catalisador é um produto químico que não muda antes ou depois de uma reação, mas acelera a reação, alterando a quantidade mínima de energia que precisa ser injetada para que a reação ocorra). Em 2023, a revista Nature Catalysis relatou sobre o processo de alcançar a conversão direta de metano com oxigênio em óxidos C1 (metanol (CH3OH), ácido fórmico (HCOOH) e metileno glicol (Hoch2OH)) usando um dissulfeto de molibdênio específico (MOS2) Catalisador a 25 ° C. Uma conversão de metano de 4,2% e quase 100% de oxigenatos C1 foi alcançada transformando metano e oxigênio em oxigenados C1 valiosos em condições ambientais. Este MOS2 é o único catalisador relatado até agora que pode realizar a conversão de temperatura ambiente de metano e oxigênio. Tudo isso se deve à geometria e estrutura eletrônica exclusivas do local MO na borda do MOS2. Este local MO possui uma alta atividade de ativação em relação a oxigênio em um ambiente aquoso, formando as espécies mágicas o = mo = o*. Esta espécie facilita a quebra da ligação carbono-hidrogênio e reduz a energia de ativação da ligação CH do metano, aumentando bastante a reatividade do metano e, assim, realizando a ativação de baixa temperatura do metano e oxigênio. Essa descoberta trará mais possibilidades de utilização de energia futura e proteção ambiental, além de nos dar uma compreensão mais profunda do papel incrível dos catalisadores e auxiliares.
3. Significado estratégico significativo da ativação de baixa temperatura do metano Perceber a conversão catalítica direta de metano e oxigênio à temperatura ambiente e converter metano em gás natural em outros produtos químicos úteis pode melhorar bastante a taxa de utilização do gás natural, reduzir o desperdício e proteger melhor o meio ambiente e realizar o desenvolvimento sustentável da energia . Em segundo lugar, como um gás de efeito estufa, o metano é perdendo apenas para dióxido de carbono em sua contribuição para o aquecimento global. Se o metano puder ser convertido em outras substâncias, pode nos ajudar a reduzir a emissão de poluentes do ar (por exemplo, óxidos de carbono, óxidos de nitrogênio, óxidos de enxofre, hidrocarbonetos e compostos de éter) e aliviar a pressão do aquecimento global.




